Model Atom Rutherford
Model atom Rutherford ini merupakan kelanjutan dari penelitian yang telah dilakukan oleh Henry Becquerel (1852-1908) dan Philipp Lenard (1862-1947).
Tahun 1896 Henry Becquerel menemukan uranium dan senyawa-senyawanya secara spontan memancarkan partikel-partikel. Partikel yang dipancarkan ada yang bermuatan listrik dan memiliki sifat yang sama dengan sinar katode atau electron. Unsur-unsur yang memancarkan sinar itu disebut unsure radioaktif dan sinar yang dipancarkan disebut sinar radioaktif. Ada tiga macam sinar radioaktif yaitu sinar alfa (α), sinar (β) dan sinar gama (γ).
- Sinar α mempunyai kekuatan ionisasi besar tetapi daya tembusnya terhadap materi rendah. Sinar ini dapat ditahan oleh kertas biasa. Sinar ini adalah partikel yang membawa 2 satuan dasar muatan + dan mempunyai massa identik dengan He (Sinar α = ion He2+).
- Sinar β sebaliknya memiliki kekuatan ionisasi rendah dan daya tembus besar. Sinar ini dapat melewati lempeng alumunium setebal 3 mm. Sinar ini memiliki partikel bermuatan negatif dengan e/m sama seperti elektron.
- Sinar γ mempunyai daya tembus sangat besar dan tidak dibelokkan oleh medan listrik dan magnit.
Tahun 1903 Philipp Lenard memodifikasi tabung sinar katode dengan menempatkan suatu jendela dari lempeng Aluminium yang sangat tipis, lalu ia mengamati perilaku electron yang menembus lempeng tersebut. Jika model atom Thomson benar, maka berkas electron yang menembus lempeng akan kehilangan banyak energy sehingga electron akan dibelokkan, ternyata sebagian besar berkas electron tidak dapat dibelokkan. Hal ini membuktikan model atom Thomson yang menyatakan bahwa electron tersebar merata dalam muatan positif atom adalah tidak benar.
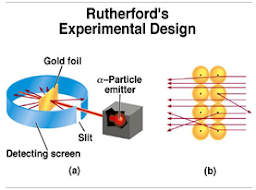
Pada tahun 1911, Rutherford bersama dua orang muridnya (Hans Geigerdan Erners Masreden) melakukan percobaan yang dikenal dengan hamburan sinar alfa (α) terhadap lempeng tipis emas.Percobaan tersebut sebenarnya bertujuan untuk menguji pendapat Thomson, yakni apakah atom itu betul-betul merupakan bola pejal yang positif yang bila dikenai partikel alfa akan dipantulkan atau dibelokkan. Dari pengamatan mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada lempeng emas yang sangat tipis, maka sebagian besar partikel alfa diteruskan (ada penyimpangan sudut kurang dari 1°), tetapi dari pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel alfa akan membelok sudut 90° bahkan lebih.
Berdasarkan gejala-gejala yang terjadi, diperoleh beberapa kesimpulan berikut:
- Atom bukan merupakan bola pejal, karena hampir semua partikel alfa diteruskan
- Didalam atom terdapat partikel yang sangat kecil yang bermuatan positif, partikel tersebut merupakan partikelyang menyusun suatu inti atom.
- Besarnya muatan positif adalah berbeda antara satu atom dengan atom lainnya
- Banyaknya electron disekitar inti atom sama dengan muatan positif pada inti atom, jadi atom bersifat netral.
Berdasarkan fakta-fakta yang didapatkan dari percobaan tersebut, Rutherford mengusulkan model atom yang dikenal dengan Model Atom Rutherford yang menyatakan bahwa: “Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif”. Rutherford menduga bahwa didalam inti atom terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak menolak. Model atom Rutherford dapat digambarkan sebagai beriukut:
Kelebihan Model Atom Rutherford
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
Kelemahan Model Atom Rutherford :
Ketidakmampuan untuk menjelaskan mengapa elektron tidak jatuh ke inti atom akibat gaya tarik elektrostatis inti terhadap elektron, hal ini bertentangan dengan teori mekanika dari Maxwell.Menurut teori Maxwell, ”jika elektron bergerak mengelilingi inti atom, maka elektron akan kehilangan energi dalam bentuk radiasi, kemudian karena elektron bermuatan negatif akan ada gaya tarik menarik dengan muatan positif di inti atom, akibatnya energi elektron makin lama akan habis dan akan semakin tertarik ke inti dan lama kelamaan akan jatuh ke inti”.

Belum ada Komentar untuk " Model Atom Rutherford"
Posting Komentar